2016年のノーベル医学生理学賞は、大隅良典・東京工業大学教授の「オートファジーの仕組みに関する発見」に対して与えられた。オートファジーとはどういう現象なのか、今までに何が明らかにされたのか、そして何が明らかになっていないのか。まだまだ課題の多いオートファジー研究、本稿を読んで少しでも興味を持っていただき、オートファジー研究に参加して下さる学生さんが出て下されば幸いである。
なお、オートファジーに関する総説や解説は巷に多く出回っているので、今回普通とは少し異なる切り口で説明を試みた。一般的な解説については筆者の所属研究室(東京大学大学院医学系研究科分子生物学分野)のHPや、教授の執筆した一般書を参考されたい。
分子生物学分野HP http://square.umin.ac.jp/molbiol/index.html
水島教授が執筆した書籍
『細胞が自分を食べる オートファジーの謎』 水島昇(著)PHPサイエンスワールド新書
『オートファジー』 水島昇・吉森保(編集)化学同人
なお、東京大学内では医学部医学系研究科 分子生物学分野(http://square.umin.ac.jp/molbiol/index.html)において盛んにオートファジーの研究を行っている。大隅良典氏とともにオートファジー研究を牽引してきた水島昇氏が研究室を主宰している。
「半閉鎖系」としての細胞とオートファジー
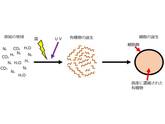
46億年前に誕生したばかりの地球は、二酸化炭素や水蒸気、窒素やメタンといった無機分子で満たされており、そして高温であった(図1左)。地球が徐々に冷えるにつれ、水蒸気が凝集し激しい雷雨が発生した。地表を激しく裂く雷と太陽から降り注ぐ紫外線は、無機化合物しかなかった地球上に生命の元となる有機物質を生み出した(図1中央)。生み出された有機物質は、原始の海の中で混じりあい、集合し、細胞を形成した。すなわち、脂質でできた膜の中に有機物質を高度に濃縮させて生化学反応を起こしながら、自律的に行動・増殖するようになったのだ(図1右)[1]。
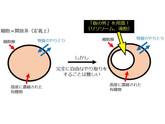
このようにして形成された細胞は、いわば「半閉鎖系」であるといえる。定義上、細胞は開放系である。外界と物質のやり取り自体は行うからだ。しかし、有機物質を高度に濃縮しているため、自由に物質の往来が起こるというタイプの開放系であっては生命を維持することはできない。細胞は開放系でありながらほとんど閉鎖している、いわば「半閉鎖系」なのである(図2左)。
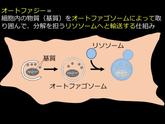
「半閉鎖系」としての細胞内には「仮の外」が用意されることになる。これがリソソーム(酵母や植物においては液胞)である。細胞は、不要になった物質を「仮の外」であるリソソームや液胞に輸送して分解・再利用している(図2右)。オートファジーは、細胞内の「仮の外」であるリソソームや液胞に細胞内の物質を輸送するシステムである。
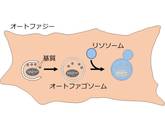
輸送の様式には主に3つあるが、最もよく研究されているのはマクロオートファジーである[2]。マクロオートファジーの実行において主役を担うのは、二重膜構造体であるオートファゴソームだ。オートファジーが誘導されるとオートファゴソームが細胞内の物質を取り囲み、口を閉じる(図3左から中央にかけて)。口を閉じたオートファゴソームはリソソームと融合する(図3中央から右)。リソソームと融合したオートファゴソームには、リソソーム内の分解を担う酵素群が流れみ、中の物質が分解される(図3右)。
他に、リソソームに物質が直接取り込まれるミクロオートファジー、シャペロンと呼ばれる分子によって介在されるシャペロン介在性オートファジーなどが知られている。詳細については参考文献を参照いただきたい。なお、単にオートファジーというとマクロオートファジーを指すことが多い。本稿でも以後オートファジーと書いたらマクロオートファジーを指すものとする。
[広告]
オートファジーの分子機構
リソソームを発見したベルギーの生化学者であるChristian de Duveは、1950年代よりオートファジーの存在を提唱していた。その後、電子顕微鏡によりオートファゴソームの存在の確認はされてきていたが、詳しい分子機構については長年謎に包まれたままであった[3]。
長い氷河期にピリオドを打ったのが、大隅良典博士だ。研究者として華々しいキャリアを送ってきたとはいい難かった博士は、しかし、長いこと無視され続けていたオートファジーの謎に着実に迫りつつあった。
現在の生命科学は、分子生物学的な理解が主流となっている。ある現象に関わる分子を同定し、それらの分子をたよりに現象の動態や意義を探るのである。大隅博士がオートファジーに着目したころ、オートファジーに関わる分子は何一つとして知られていなかった。したがって、電子顕微鏡でオートファゴソームと思しき構造を見つけるなどの限られた方法以外、現象を捉えることも、ましてやその意義を知ることも難しかった。
オートファジーに取り組み始めた大隅氏も、まずはオートファジー関連分子群を明らかにする必要があった。氏は、留学先で扱っていた酵母を用いることにした。遺伝子操作が容易で、モデル生物として非常に優れていたからだ。生体ではたらく分子は遺伝子上にその情報が記録されている。したがって、生体内分子について知りたければ遺伝子の情報を操作することで分子の挙動を操作し、その結果を吟味することで分子について知ることができる。たとえば、分子Aがオートファジーを起こしているとすれば、分子Aの情報が記録されている遺伝子Aを破壊した時、オートファジーが起こらなくなる。
酵母の遺伝子にランダムな変異を導入する。その中にはオートファジーを起こすことのできない株も出てくるはずだ。その株で変異を起こしている遺伝子を同定すれば、オートファジーに必要な分子が同定されるはずである。このように、ランダムに変異を導入してある現象に関わる分子の探索を行うことを、分子生物学分野ではしばしばスクリーニングと呼ぶ。
氏は、スクリーニングに先立ち、pep4と呼ばれる分子を欠損した酵母を作成した。この分子が欠損していると、液胞が十分に活性化しない。オートファジーの進行にともなってオートファゴソームは液胞内に運ばれて分解されるが、pep4変異体酵母ではオートファゴソームが分解されずに蓄積する。オートファジーが正常に起こっていれば、液胞に運び込まれたオートファゴソームが液胞内に蓄積して顕微鏡で容易に観察できるようになる。
pep4変異株に、ランダムな遺伝子変異を起こさせる。もしオートファジーに必要な遺伝子に変異が入り、オートファジーを起こせなくなると、液胞に蓄積するオートファゴソームが観察されなくなる。このスクリーニング系を利用して、氏は最初のオートファジー関連分子apg1を同定した。
次に、氏はapg1変異株で、窒素源飢餓時の生存率が低下することを見出した。その性質を利用することによってより効率的なスクリーニングを行い、14個のオートファジー関連因子を一度に同定した[4]。この成果は1993年、FEBS Lettersに掲載された。
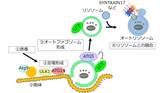
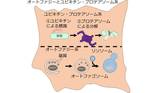
大隅氏らをはじめとした研究者たちの努力により、現在では40を超えるオートファジー関連分子が知られており、そのメカニズムについても徐々に明らかにされつつある。哺乳類の場合について簡単に紹介する。誘導シグナルが入ると、ULK1、ATG9、ATG14といった分子群によって小胞体(細胞内ではたらく器官の一つ)上に足場が形成される(図4右)。そして、ATG5やLC3などがオートファゴソーム上で協調的にはたらき、その完成に寄与する(図4中央)。完成したオートファゴソームは、SYNTAXIN17を中心とした分子群のはたらきによってリソソームと融合する(図4右)[2][5][6]。
非常に数多くの分子がオートファジーの進行に寄与しているが、それらの具体的な機能については未知であることが多い。オートファジーの分子機構を解説する図は、ほとんどが楕円の分子名と何を表すのかわからない矢印で構成されてしまっていることは、それを如実に表している。
オートファジーの生理機能
オートファジーの生理機能で最も有名なものは、飢餓への適応である。酵母では、オートファジーを行うことのできない株は飢餓条件下で顕著な生存率の低下を示す[4]。
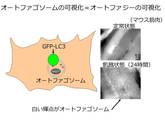
哺乳動物ではどうであろうか。そのことを調べるために、全身でオートファジーが起こる様子を観察できるマウスが開発された[7]。GFP(緑色蛍光タンパク質)は緑色の蛍光を発する。遺伝子工学の手法を用いて、オートファゴソームに局在する分子であるLC3をGFPで標識すると、オートファゴソームが緑色に光って見えるようになる(図5左)。オートファジーが起こり、オートファゴソームが形成される様子を顕微鏡で観察できるようになったのだ。
このマウスを用いて調べると、哺乳類でも飢餓条件下でオートファジーが盛んに起こっている様子が観察された(図5右)。酵母で重要だった飢餓への適応を、哺乳類でもオートファジーが担っていることが確認されたのだ。
哺乳動物にとって、人(猫,犬,鼠,馬,熊,猿,etc)生最大の飢餓は、出生直後に母胎から切り離された瞬間である。その間の飢餓への適応にオートファジーは特に重要である。オートファジーを行えないマウスは、出生時の飢餓を乗り切ることができずに死んでしまう[8]。
哺乳動物では、細胞内の恒常性を維持する機能も重要であることが分かってきている。私たちの細胞は、遺伝子の情報をもとにして常にタンパク質を合成し続けている。しかし、合成は常に成功するとは限らず、高頻度で失敗を起こす。合成に失敗したタンパク質や不要になったタンパク質は常に除去されていかなければならない。
細胞内から不要になったタンパク質を除去する仕組みとして、オートファジーはユビキチン・プロテアソーム系と並んで重要な仕組みである。ユビキチン・プロテアソーム系は、非常に選択的な分解系である。不要になったタンパク質はユビキチンで標識され、プロテアソームによって分解される(図6上)。一方、オートファジーは、主に非選択的で大規模な分解を担う。一度に大量のタンパク質を取り込み、分解する(図6下)[2]。
オートファジーは大量のタンパク質を分解し、細胞内の恒常性を維持することで、細胞の機能を保っていると考えられている。たとえば、神経細胞でオートファジーを起こせないマウスは、神経細胞内に不要なタンパク質が蓄積し、運動障害を示す[9][10]。肝臓においても、オートファジーによる細胞内の恒常性維持が重要な役割を果たしていることが報告されている[11][12]。
オートファジーは、他に、抗原提示、胚発生、病原体の分解、がん形成抑制など、数多くの生理的な役割を担っていることが知られている。詳細についてはその他の書籍や文献を参考にしていただきたい。
[広告]
残された謎
オートファジーに関する論文は一週間に100報ほど出版されているが、まだまだ謎は多く課題も山積している。分子機構・生理的意義・測定法の3つに分けて概説する。
分子機構については、関連分子が多く同定されたが、多くは正確な機能が未知のままである。オートファゴソームの膜がどこからくるのか、役目を終えたオートファゴソームはどこへいくのかについても分かっていない。また、オートファジーは細胞内の物質をリソソームへと輸送するシステムである。そのためにはまずオートファジーの口がしっかり閉じること、また、口を閉じた後には二重膜のうち内膜だけが選択的に除去されねばならない。オートファジーをオートファジーたらしめるこの二つの過程についても、どのようにして起こっているのか分かっていない。
生理機能については、主に飢餓応答と細胞内の恒常性維持に重要だということがわかっている。しかし、飢餓時にオートファジーで何を分解し、何を作り出しているのかわかっていない。また、恒常性維持についても、具体的にどのような分子を分解するのが大事なのかなどを中心に、明らかにされていない部分が大きい。
オートファジー活性を評価する方法は、非常に限られており複雑だ。オートファゴソームを可視化することはできるが、オートファゴソームの数が多いことは、形成が促進されているときのみならず、リソソームとの融合が阻害されるなど、後期過程が障害されていることでも起こりうる。これらの課題を克服するために種々の方法が試みられているが、哺乳類、特に生きている個体でのオートファジー活性の測定はほとんど不可能である。
ノーベル賞をとるような分野は非常に完成された分野であると思う方も多いかもしれない。しかし、オートファジーには重要で魅力的な課題が残されている。本稿を読んで下さった若い学生の皆さんが、一人でも多くオートファジー研究に参加して下さることを祈りながら筆を擱くこととする。
[1] 石川春律 監修 標準細胞生物学第2版(2008)
[2] Mizushima, N. & Komatsu, M. Review Autophagy : Renovation of Cells and Tissues. Cell 147, 728–741 (2011).
[3] Klionsky, D. J. Autophagy revisited: A conversation with Christian de Duve. Autophagy 4, 740–743 (2008).
[4] Tsukada, M. & Ohsumi, Y. Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae. FEBS Lett. 333, 169–174 (1993).
[5] Itakura, E., Kishi-Itakura, C. & Mizushima, N. The hairpin-type tail-anchored SNARE syntaxin 17 targets to autophagosomes for fusion with endosomes/lysosomes. Cell 151, 1256-1269 (2012).
[6] Tsuboyama, K., et al. The ATG conjugation systems are important for degradation of the inner autophagosomal membrane. 6136, 1–10 (2016).
[7] Mizushima, N. et al. In Vivo Analysis of Autophagy in Response to Nutrient Starvation Using Transgenic Mice Expressing a Fluorescent Autophagosome Marker. Mol. Biol. Cell 15, 1101–1111 (2004).
[8] Kuma, A. et al. The role of autophagy during the early neonatal starvation period. Nature 432, 1032–1036 (2004).
[9] Hara, T. et al. Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice. Nature 441 15, 885–889 (2006).
[10] Komatsu, M. et al. Loss of autophagy in the central nervous system causes neurodegeneration in mice. Nature 441, 880–884 (2006).
[11]Komatsu, M. et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J. Cell Biol. 169, 425–434 (2005).
[12] Takamura, A. et al. Autophagy-deficient mice develop multiple liver tumors. Genes … 5, 795–800 (2011)